Impiego di spettroscopia di immagini per la rilevazione rapida di aflatossine su granella di mais

Per il mais è importante avere degli strumenti che possano fornire in maniera rapida e semplice una chiara indicazione del livello di contaminazione da micotossine; soprattutto nella fase di conferimento ai centri di stoccaggio, al fine di segregare le partite in ingresso particolarmente a rischio, risulta necessario disporre di metodiche rapide e sufficientemente indicative del contenuto di aflatossine, le micotossine più pericolose della filiera maidicola. Attualmente, sui conferimenti a elevato rischio, cioè con umidità della granella inferiore al 20%, devono essere effettuati opportuni controlli tramite dei sistemi rapidi di screening, generalmente basati sull’impiego di semplici lampade UV che evidenziano, tramite fluorescenza, le cariossidi potenzialmente contaminate.
Nell’ambito della misura d’innovazione Q2SC (Qualità Sicurezza Sostenibilità Cereali) del progetto di filiera di Grandi Colture Italiane, Proambiente (consorzio costituito dagli enti pubblici CNR di Bologna e Università di Ferrara) e alcuni soggetti privati (11 piccole e medie imprese che hanno sede nella Regione Emilia-Romagna), si è occupato di testare un prototipo di strumento che avesse la possibilità di effettuare un rapido pre-screening (tempo di misura inferiore a 5 minuti) di campioni di granella di mais per valutare la eventuale presenza di aflatossine.
La presenza di aflatossine nella catena produttiva degli alimentari è un problema ben noto e per questo motivo sono state sviluppate diverse metodiche di rilevamento e controllo. Tra queste tecniche analitiche la cromatografia liquida ad alta prestazione (HPLC) e la spettrometria di massa (SM) si distinguono per l’alta accuratezza. Per contro esse necessitano di un laboratorio e di personale specializzato, risultano costose e richiedono tempi di esecuzione lunghi. Inoltre le misurazioni di questo tipo spesso forniscono limitate informazioni per la caratterizzazione spaziale quando si esamina l’intero campione. Per questo motivo è necessaria la predisposizione di un sotto-campione altamente rappresentativo con grosse complicazioni operative nel caso di grandi masse di granella da campinare.
L’impiego di tecniche non distruttive e in particolare la spettroscopia a immagini (Hyper Spectral Imaging) è considerato un approccio innovativo in grado di fornire un’ampia gamma di informazioni nel controllo della catena agro-alimentare.
Oltre all’aflatossina, sulla granella di mais contaminato, si può ritrovare un metabolita secondario del fungo produttore, l’acido kojico che sottoposto ad una fonte di luce UV sviluppa una fluorescenza giallo-verdastra brillante (bright greenish-yellow fluorescence BGYF). Quest’ultimo composto è spesso presente quando il fungo tossinogeno Aspergillus flavus metabolizza l’aflatossina. Sebbene ulteriori indagini abbiano realizzato che questa conclusione non era sempre verificabile, l’acido kojico può produrre all’indagine spettroscopica sovrapposizioni di picchi che possono interferire con i picchi caratteristici dell’aflatossina. Pertanto, l’obiettivo dello studio era determinare la fattibilità della tecnologia basata sull’immagine per confrontare l’aflatossina misurata da uno spettro-fluoro-fotometro con quella misurata sulla base delle immagini acquisite con un sensore iperspettrale a fluorescenza e determinare potenziali sovrapposizioni di picco confondenti la lettura. Per una affidabile rilevazione e quantificazione dell’aflatossina è stato allestito da Proambiente un sistema da laboratorio (figura 1), composto da strumento Acusto-Optical Imaging Spectrometer (AOIS) e una sorgente UV, montati su un supporto meccanico con movimentazioni tali da facilitare la messa a fuoco del campione osservato.

Lo strumento AOIS acquisisce singoli fotogrammi del campione osservato nel range 390 nm ÷ 620 nm con passo di 2 nm. Con questo passo spettrale AOIS è in grado di acquisire più di 100 fotogrammi, funzionando dunque come un strumento di tipo iperspettrale.
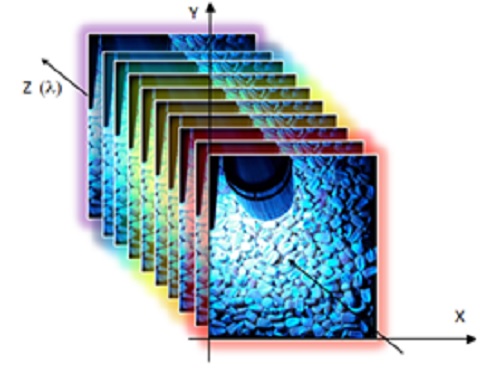
Con i fotogrammi acquisiti da AOIS si crea il cosiddetto cubo iperspettrale (figura 2), che fornisce informazioni spaziali con elevata risoluzione dello scenario/oggetto osservato (X, Y), mentre lungo l’asse (Z) si ottengono informazioni spettrali.
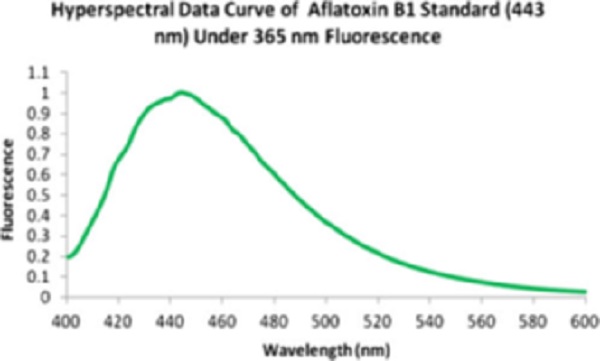
Dalla ricerca bibliografica effettuata nella prima fase del progetto si è concluso che la radiazione luminosa in grado di stimolare la fluorescenza dell’aflatossina in maniera efficace è fissata a 365 nm. La banda spettrale della fluorescenza dell’AF si estende da 400 nm fino a 600 nm, con FWHM nell’intervallo 410 nm ÷490 nm (figura 3).
I primi test per mettere a punto l’assetto strumentale sono stati effettuati con alcuni campioni di mais delle raccolte degli anni 2017 e 2018, dimostrando come la spezzatura dei chicchi di mais, molto più presente nel 2018, determina nella zona spettrale 570-600 nm un forte segnale di riflettanza, il quale non ha il carattere di fluorescenza dell’acido kojico, dovuto alla presenza di funghi di tipo Aspergillus.
Avvalendosi del fatto che le misurazioni con lo strumento AOIS sono di tipo iperspettrali, è stata verificata l’opportunità di ricavare dai fotogrammi l’eventuale presenza di aflatossina nei singoli granelli di mais. Per questo motivo è stata calcolata la differenza tra due fotogrammi ottenuti in due lunghezze d’onda: una in cui la fluorescenza non si pronuncia e un’altra dove è il massimo della fluorescenza.
Nel 2018 sono stati acquisiti in laboratorio cubi iperspettrali di 42 campioni di mais, i quali, secondo le misurazioni in HPLC effettuate presso l’Università Cattolica del Sacro Cuore di Piacenza, presentavano diversi livelli di contaminazione di aflatossina AFB1. Tra tutti i campioni esaminati sono state scelti 3 campioni che rappresentavano diversi livelli di contaminazione allo scopo di creare un’ampia scala, comprendente la soglia riferita all’alimentazione umana.
Dal confronto degli spettri non si è dimostrata però una chiara differenza tra i campioni, proporzionale al loro contenuto di aflatossina. Per questo motivo i segnali più alti sono stati attribuiti alla riflettanza di tipo speculare e non alla presenza di aflatossina.
Nel 2019 sono proseguite le misurazioni con 50 campioni prelevati presso il centro di conferimento di CAPA Vigarano Pieve (FE). Da un operatore specializzato del centro è stata rilevata la presenza di chicchi fluorescenti tramite osservazione visuale con lampada UV di emissione di BGYF.
Considerando che la selezione di diverse lunghezze d’onde offre la possibilità di elaborare una soglia in termini numerici, sulla base di una ricerca bibliografica è stato valutato che il metodo Spectral Angle Mapper (SMA) fosse l’approccio più appropriato per le analisi dei cubi iperspettrali ottenute con lo strumento AOIS. Questo metodo, largamente utilizzato nelle elaborazioni delle immagini iperspettrali, offre la possibilità di rilevare la presenza di diverse classi di interesse dal punto di vista spettrale, rispetto al riferimento con proprietà spettrali ben note.
Utilizzando i fotogrammi del cubo iperspettrale riferito all’aflatossina ed elaborando uno specifico programma di calcolo, si è creata una mappa di presenza (figura 4) in cui è possibile individuare singoli chicchi di mais che contribuiscono al segnale misurato nella zona spettrale che caratterizza la fluorescenza dell’aflatossina.
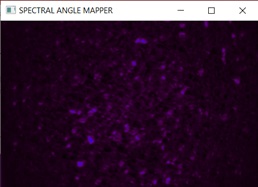
La mappa deve essere calibrata utilizzando i risultati dalle misurazioni con il metodo HPLC (High Performance Liquid Chromatofraphy). In questo modo si potrà definire una soglia del segnale di ciascun pixel della mappa SMA, la cui somma sarà uguale al livello di contaminazione del campione ottenuto con la tecnica HPLC.
A questo proposito sarà necessario continuare la collaborazione tra Proambiente e Grandi Colture Italiane con la messa a disposizione di campioni e di relative analisi della contaminazione da micotossine anche per l’annata 2020.




